ICH là gì? Cơ cấu, trách nhiệm, sứ mệnh và Các nước tham gia ICH
Ngành dược phẩm là một lĩnh vực quan trọng và nhạy cảm, liên quan trực tiếp đến sức khỏe và sự phát triển của con người. Vì vậy, việc đảm bảo chất lượng và an toàn của thuốc trở thành một nhu cầu cấp bách và được quan tâm rộng rãi trên toàn thế giới. Và ICH là một trong những tổ chức hàng đầu đứng ra thúc đẩy sự phát triển bền vững của ngành dược
Cùng Thiết bị phòng sạch VCR tìm hiểu xem ICH là gì và cơ cấu tổ chức, sứ mệnh, trách nhiệm của ICH cũng như các nước tham gia thông qua bài viết này nhé.
ICH là gì
ICH (International Conference on Harmonization) là một sáng kiến quốc tế nhằm tập hợp các cơ quan quản lý và ngành công nghiệp dược phẩm để thảo luận về các khía cạnh khoa học và kỹ thuật trong phát triển và đăng ký sản phẩm dược phẩm.

ICH được dịch là Hội nghị Quốc tế về Hài hòa hóa các Thủ tục Đăng ký Dược phẩm sử dụng cho Con người và Hội đồng Quốc tế về Hài hòa các Yêu cầu Kỹ thuật đối với Dược phẩm.
Cơ cấu tổ chức của ICH
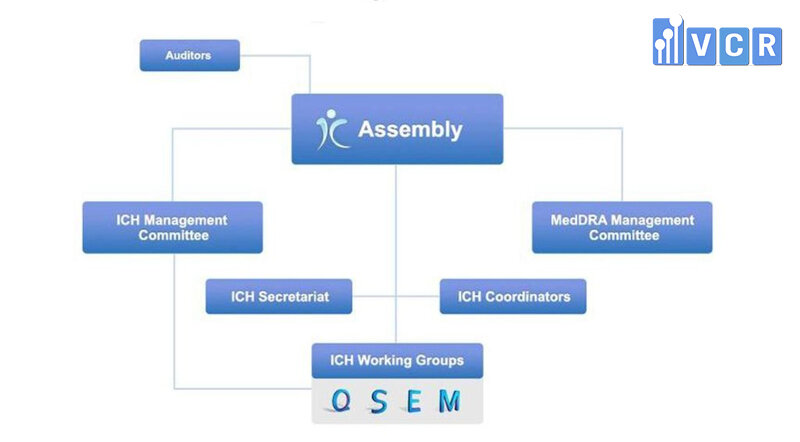
Hội đồng ICH (Assembly)
Trong cơ cấu tổ chức của ICH, Hội đồng ICH là cơ quan chủ quản tập hợp tất cả các thành viên và quan sát viên của Hiệp hội ICH. Hội đồng có trách nhiệm thông qua các quyết định cụ thể về các vấn đề trong các điều khoản của Hiệp hội, kết nạp thành viên và quan sát viên mới và thông qua các nguyên tắc, hướng dẫn của ICH.
Hội đồng ICH họp định kỳ sáu tháng một lần. Tất cả các chương trình nghị sự, cũng như các báo cáo trong hội nghị đều được đăng tải trên trang web của ICH (https://www.ich.org/), giúp tóm tắt các quyết định chính được đưa ra tại mỗi cuộc họp.
Chủ tịch Hội đồng ICH là bà Lenita Lindström-Gommers (EC*, Châu Âu) và Phó chủ tịch Hội đồng là Tiến sĩ Celia Lourenco (Bộ Y tế Canada, Canada).
Ủy ban quản lý ICH (ICH Management Committee)
Ủy ban quản lý ICH (MC) được xem là cơ quan quản lý hoạt động của ICH, đại diện cho tất cả các thành viên của tổ chức. Nhiệm vụ chính của MC là giải quyết các vấn đề liên quan đến hành chính, tài chính và giám sát các nhóm công tác (Working Groups - WGs) của ICH. Để chuẩn bị cho các cuộc thảo luận, MC gửi các đề nghị hoặc đề xuất cho Hội đồng ICH. Đến nay, MC đã có 14 thành viên điều tiết (bao gồm EC Châu Âu, EFPIA, FDA Hoa Kỳ, JPMA, MHLW/PMDA Nhật Bản và PhRMA) và hai quan sát viên thường trực (bao gồm IFPMA và WHO).
Chủ tịch của Ủy ban quản lý ICH hiện tại là Tiến sĩ Theresa Mullin, đại diện cho FDA Hoa Kỳ, và Phó Chủ tịch là Tiến sĩ Nobumasa Nakashima, đại diện cho MHLW/PMDA Nhật Bản. Tất cả các biên bản của các cuộc họp trực tiếp và báo cáo tóm tắt các cuộc họp từ xa của MC đều được công bố trên trang web chính thức của ICH.
Ủy ban quản lý MedDRA (MedDRA Management Committee)
Ủy ban quản lý MedDRA (MedDRA Management Committee) là một tổ chức trong cấu trúc của ICH, có trách nhiệm quản lý MedDRA - một từ điển tiêu chuẩn của ICH về thuật ngữ y tế. Các thành viên trong ủy ban này bao gồm EC (Châu Âu), EFPIA, MHLW / PMDA (Nhật Bản), JPMA, FDA (Hoa Kỳ), PhRMA, MHRA* (Vương quốc Anh), Y tế Canada và WHO (với tư cách là người quan sát).
Chủ tịch của ủy ban là ông Mick Foy, đại diện cho MHRA (Vương quốc Anh).
Ban thư ký ICH (ICH Secretariat)
Ban thư ký ICH (ICH Secretariat) là tổ chức có trách nhiệm quản lý ICH hàng ngày, điều phối các hoạt động của ICH cũng như hỗ trợ cho hội đồng ICH, ủy ban quản lý ICH, ủy ban quản lý MedDRA và các nhóm làm việc khác. Hiện nay, ban thư ký ICH đặt tại Geneva, Thụy Sĩ.
Các nhóm làm việc
Tổ chức ICH quy định một nhóm làm việc ICH (ICH Working group - WG) được thành lập khi một chủ đề kỹ thuật mới được chấp nhận để hài hòa hóa. Các chuyên gia phù hợp được chỉ định tham gia vào nhóm làm việc bởi các thành viên và quan sát viên của ICH. Hội đồng ICH sẽ chỉ định một báo cáo viên để dẫn dắt các cuộc thảo luận khoa học của WG. Ủy ban quản lý ICH giám sát công việc của nhóm làm việc và báo cáo lại tiến trình cho hội đồng ICH tại các cuộc họp mặt trực tiếp diễn ra hai năm một lần.
Mỗi nhóm làm việc được giao nhiệm vụ xây dựng một hướng dẫn ICH hài hòa, đáp ứng các mục tiêu được nêu trong giấy phép và kế hoạch kinh doanh. Kế hoạch làm việc của mỗi WG đều được công bố công khai theo từng chủ đề trên trang web ICH. Hướng dẫn ICH đã cung cấp các tiêu chuẩn thống nhất về các yêu cầu kỹ thuật đối với dược phẩm cho con người giữa các quốc gia. Điều này đã giúp các nước sử dụng hợp lý hơn các nguồn lực, loại bỏ sự chậm trễ trong nghiên cứu, phát triển và phân phối thuốc mà vẫn đảm bảo chất lượng và an toàn cho người tiêu dùng.
Sứ mệnh, yêu cầu và chức năng của ICH
Sứ mệnh của ICH
Harmonisation for Better Health – Sự hài hòa để có sức khỏe tốt hơn
ICH đặt ra sứ mệnh của mình là đạt được sự hài hòa hơn trên toàn cầu để đảm bảo rằng các loại thuốc an toàn, hiệu quả và chất lượng cao được phát triển và đăng ký theo cách hiệu quả nhất về nguồn lực.
Để đạt được sự hài hòa trong việc giải thích và áp dụng các hướng dẫn và yêu cầu kỹ thuật đối với việc đăng ký và duy trì các sản phẩm dược, ICH đã xây dựng các Hướng dẫn thông qua một quá trình đồng thuận khoa học giữa các chuyên gia ngành dược và các cơ quan quản lý, chính quyền. Thành công của quá trình này phụ thuộc vào cam kết của các cơ quan quản lý ICH trong việc thực hiện các Hướng dẫn cuối cùng. Sứ mệnh của ICH đã được phản ánh trong các Điều khoản của Hiệp hội, bao gồm:
- Đưa ra các khuyến nghị để đạt được sự hài hòa hơn trong việc giải thích và áp dụng các hướng dẫn và yêu cầu kỹ thuật đối với việc đăng ký sản phẩm dược và duy trì các đăng ký đó.
- Duy trì diễn đàn đối thoại mang tính xây dựng về các vấn đề khoa học giữa cơ quan quản lý và ngành dược về việc hài hòa các yêu cầu kỹ thuật đối với sản phẩm dược.
- Góp phần bảo vệ sức khỏe cộng đồng vì lợi ích của người bệnh từ góc độ quốc tế.
- Theo dõi và cập nhật các yêu cầu kỹ thuật nhằm mục tiêu đạt được sự chấp nhận lẫn nhau nhiều hơn đối với dữ liệu nghiên cứu và phát triển.
- Lựa chọn các chủ đề cần thiết từ các tiến bộ trong việc trị liệu và phát triển công nghệ mới để sản xuất dược phẩm, nhằm tránh những yêu cầu xung đột trong tương lai.
- Tạo điều kiện cho việc áp dụng các phương pháp tiếp cận nghiên cứu và phát triển kỹ thuật mới hoặc cải tiến, cập nhật hoặc thay thế các thực tiễn hiện tại.
- Khuyến khích việc thực hiện đầy đủ và tích hợp các tiêu chuẩn chung thông qua việc phổ biến, truyền đạt thông tin và phối hợp đào tạo về các hướng dẫn hài hòa và việc sử dụng chúng.
- Đảm bảo tiêu chuẩn hóa, phát triển và phổ biến MedDRA như một từ điển khoa học và kỹ thuật để tạo điều kiện cho việc chia sẻ thông tin pháp lý quốc tế về các sản phẩm thuốc.
Yêu cầu của ICH
Yêu cầu của Hiệp hội ICH bao gồm việc phê duyệt kế hoạch hoạt động và ngân sách thông qua các quyết định cụ thể liên quan đến việc áp dụng Nguyên tắc ICH khi chấp nhận thành viên mới và quan sát viên mới. Các đại diện của từng thành viên phải được chỉ định vào Hội đồng và được hỗ trợ hàng ngày bởi các điều phối viên của ICH tại Ban thư ký.
Chức năng của ICH
Dưới đây là một số chức năng của ICH mà bạn cần nắm:
- Uỷ ban Quản lý ICH (MC) giám sát các khía cạnh hoạt động của ICH thay mặt cho tất cả Thành viên, giám sát của Nhóm Công tác (WGs) liên quan đến các vấn đề hành chính và tài chính.
- Uỷ ban Quản lý MedDra (MC) có trách nhiệm chỉ đạo MedDRA, thuật ngữ y tế tiêu chuẩn của ICH để hỗ trợ cho việc duy trì, phát triển và phổ biến MedDRA.
- Ban thư ký ICH chịu trách nhiệm quản lý ICH hàng ngày, điều phối các hoạt động của ICH cũng như hỗ trợ cho Hội đồng, MC và các nhóm làm việc. Ban thư ký ICH cũng cung cấp hỗ trợ cho MedDRA MC và được đặt tại Geneva, Thụy Sĩ.
- Các Nhóm Công tác (WGs) được Hội đồng thành lập khi một chủ đề kỹ thuật mới được chấp nhận để hài hòa hóa và được giao nhiệm vụ xây dựng một hướng dẫn hài hòa, đáp ứng các mục tiêu được nêu trong Kế hoạch kinh doanh và Giấy tờ.
- Các cuộc gặp mặt trực tiếp của WGs thường sẽ chỉ diễn ra hai năm một lần trong các cuộc họp ICH. Báo cáo tạm thời được thực hiện tại mỗi cuộc họp của Hội đồng và được công khai trên trang web của ICH.
ICH trong ngành dược phẩm
ICH đã phát triển các hướng dẫn cung cấp các khuyến nghị và tiêu chuẩn cho các khía cạnh khác nhau trong quá trình phát triển dược phẩm như chất lượng, an toàn, hiệu quả và các khía cạnh đa ngành. Tài liệu này được sử dụng rộng rãi bởi các cơ quan quản lý và công ty dược phẩm trên toàn thế giới, và được cập nhật liên tục để đáp ứng các phát triển khoa học và công nghệ mới nhất trong ngành.
Những hướng dẫn của ICH bao gồm nhiều chủ đề liên quan đến phát triển và quản lý dược phẩm, bao gồm:
- Chất lượng: Hướng dẫn về chất lượng của dược chất và thành phẩm thuốc, bao gồm thông số kỹ thuật, độ ổn định, tạp chất và phương pháp phân tích.
- An toàn: Hướng dẫn cho các nghiên cứu an toàn phi lâm sàng, bao gồm xét nghiệm độc tính di truyền, khả năng gây ung thư và độc tính sinh sản.
- Hiệu quả: Hướng dẫn cho các nghiên cứu lâm sàng, bao gồm thiết kế, tiến hành và báo cáo các thử nghiệm lâm sàng.
- Đa ngành: Các hướng dẫn giải quyết các chủ đề bao phủ nhiều lĩnh vực, bao gồm quản lý rủi ro, cảnh giác dược và phát triển thuốc cho trẻ em.

Thực hiện các hướng dẫn của ICH là cách giúp đảm bảo rằng các sản phẩm dược phẩm được phát triển, đăng ký và duy trì theo các tiêu chuẩn nhất quán về chất lượng, an toàn và hiệu quả, bất kể quốc gia hay khu vực nơi chúng được phát triển hay bán. Điều này giúp tối ưu hóa quy trình phê duyệt, giảm bớt sự dư thừa và thiếu hiệu quả, đồng thời đảm bảo rằng bệnh nhân có được tiếp cận với các loại thuốc an toàn và hiệu quả.
Ngoài việc xây dựng các hướng dẫn, ICH còn đóng vai trò quan trọng trong việc cung cấp một nền tảng cho các cơ quan quản lý và ngành dược phẩm hợp tác và trao đổi thông tin về các vấn đề khoa học và quy định. Việc này bao gồm cung cấp một diễn đàn để thảo luận về các công nghệ và xu hướng mới trong ngành, cũng như các cơ hội để hài hòa hóa và hội tụ các yêu cầu quy định.
Tài liệu kỹ thuật chung (CTD) là một thành tựu đáng chú ý của ICH, là định dạng được tiêu chuẩn hóa để gửi thông tin cho các cơ quan quản lý để đăng ký các sản phẩm dược phẩm. CTD cung cấp một cấu trúc và nội dung chung cho các hồ sơ đệ trình, giúp đơn giản hóa quy trình xem xét theo quy định và giúp đẩy nhanh quá trình phê duyệt các loại thuốc mới.
Nhìn chung, ICH đóng một vai trò quan trọng trong việc đảm bảo chất lượng, an toàn và hiệu quả của các sản phẩm dược phẩm trên toàn thế giới. Hướng dẫn và tiêu chuẩn của ICH được công nhận và thực hiện rộng rãi bởi các cơ quan quản lý và ngành dược phẩm trên toàn cầu.
Trách nhiệm và kế hoạch của ICH đối với thuốc và cơ sở y tế
Đối với Thuốc:
- Đối với thuốc thuộc danh mục thuốc đấu thầu tập trung cấp quốc gia và danh mục thuốc đàm phán giá, đơn vị mua thuốc tập trung cấp quốc gia phải tạo lập thông báo kế hoạch dựa trên kế hoạch có sẵn, với thời gian tối đa là 36 tháng và phân chia theo từng nhóm thuốc và tiến độ cung cấp theo quý, năm.
- Đối với thuốc thuộc danh mục thuốc đấu thầu tập trung cấp địa phương, kế hoạch sử dụng thuốc được lập theo thông báo của đơn vị mua thuốc tập trung cấp địa phương, với thời gian tối đa là 36 tháng và phân chia theo từng nhóm thuốc và tiến độ cung cấp theo quý, năm.
- Kế hoạch sử dụng thuốc của cơ sở y tế tự tổ chức lựa chọn nhà thầu được định kỳ cho thời gian tối đa 12 tháng hoặc đột xuất khi có nhu cầu, và phân chia theo từng nhóm thuốc.
Đối với các cơ sở Y tế:
Dưới đây là danh sách các hướng dẫn cho các cơ sở y tế về quản lý thuốc:
- Tổ chức lựa chọn nhà thầu cung cấp thuốc: Các cơ sở y tế cần tổ chức quá trình lựa chọn nhà thầu cung cấp thuốc một cách chặt chẽ và cẩn trọng để đảm bảo hoạt động thường xuyên của đơn vị đối với thuốc ngoài danh mục thuốc đấu thầu tập trung cấp quốc gia.
- Danh mục thuốc đấu thầu tập trung: Các cơ sở y tế cần lưu ý đến danh mục thuốc đấu thầu tập trung cấp địa phương và danh mục thuốc đàm phán giá. Danh mục thuốc đấu thầu tập trung cấp địa phương áp dụng cho các cơ sở y tế của địa phương và cơ sở y tế của trung ương đóng tại địa phương. Quản lý và thực hiện một cách nghiêm ngặt các quy định liên quan đến danh mục thuốc đấu thầu tập trung.
- Kế hoạch sử dụng thuốc: Các cơ sở y tế của trung ương cần xây dựng kế hoạch sử dụng thuốc phù hợp với các quy định về đấu thầu thuốc tập trung tại địa phương quản lý. Kế hoạch này phải được tuân thủ nghiêm ngặt để đảm bảo đủ thuốc cho các hoạt động y tế và tránh tình trạng lãng phí hay hết hạn sử dụng.
- Tổng hợp và tổ chức đấu thầu thuốc: Sở Y tế và đơn vị mua sắm tập trung cấp địa phương phải có trách nhiệm tổng hợp và tổ chức đấu thầu thuốc cho cơ sở y tế của trung ương đóng tại địa phương như đối với cơ sở y tế thuộc địa phương quản lý. Các hoạt động này cần được thực hiện một cách cẩn trọng và hiệu quả để đảm bảo sự đủ thuốc và chất lượng thuốc cho các cơ sở y tế.
Các nước tham gia ICH
Các quốc gia đang giam gia ICH: Mỹ, Nhật, Đức, Pháp, Anh, Ý, Tây Ban Nha, Bỉ, Hà Lan, Thụy Sĩ, Thụy Điển, Áo, Ba Lan, Ireland, Hy Lạp, Cộng hòa Séc, Đan Mạch, Phần Lan, Romania, Hungary, Slovenia, Slovakia, Bungari, Croatia, Estonia, Latvia, Litva, Luxembourg, Malta và Iceland.
Các nước tham gia ICH với tư cách là quan sát viên của ICH: Canada, Thụy Sĩ.3
Các nước tham gia ICH với tư cách là thành viên liên kết ICH: Australia, Norway, Iceland, Liechtenstein.
ICH đã và đang đóng vai trò vô cùng quan trọng trong ngành dược phẩm toàn cầu. Nhờ sự hợp tác và thống nhất của các nước tham gia, ICH đã đưa ra các tiêu chuẩn và hướng dẫn rõ ràng về chất lượng, an toàn và hiệu quả của các sản phẩm dược phẩm. Điều này không chỉ đảm bảo cho người dùng được sử dụng những sản phẩm chất lượng và an toàn mà còn mang lại lợi ích cho các nhà sản xuất, đồng thời nâng cao uy tín của ngành dược phẩm.
Brian














