GMP là gì? Yêu cầu, Nguyên tắc và Phân loại các tiêu chuẩn GMP | GMP EU, GMP WHO, cGMP, Pics GMP
GMP (viết tắt của Good Manufacturing Practices) là một tiêu chuẩn được sử dụng trong nhiều ngành sản xuất, đặc biệt là Dược phẩm. Vậy GMP là gì? Tiêu chuẩn và quy trình chứng nhận GMP như thế nào?
- GMP là gì
- Các loại tiêu chuẩn GMP
- Các nội dung chính của tiêu chuẩn GMP
- 10 Nguyên tắc cơ bản của GMP
- Nguyên tắc 1: Thiết kế nhà xưởng đúng ngay từ đầu
- Nguyên tắc 2: Quy trình thẩm định
- Nguyên tắc 3: Viết ra các quy trình và làm theo quy trình đã viết
- Nguyên tắc 4: Xác định ai làm cái gì?
- Nguyên tắc 5: Ghi chép hồ sơ tốt
- Nguyên tắc 6: Đào tạo và phát triển nhân viên
- Nguyên tắc 7: Thực hành vệ sinh tốt
- Nguyên tắc 8: Bảo dưỡng nhà xưởng và thiết bị
- Nguyên tắc 9: Thiết kế chất lượng dựa vào toàn bộ vòng đời sản phẩm
- Nguyên tắc 10: Thanh tra thường xuyên
- Chứng chỉ, chứng nhận và quy trình đạt chứng nhận GMP
- Các tiêu chuẩn GMP trong sản xuất dược phẩm
- Những ngành cần áp dụng tiêu chuẩn GMP
- Lợi ích của tiêu chuẩn GMP
Trong quá trình sản xuất sản phẩm ngày nay, việc đặt ra và tuân thủ các tiêu chuẩn là điều không thể thiếu. Và GMP là một trong số đó, đây là một tiêu chuẩn được áp dụng trong rất nhiều ngành, đặc biệt là ngành dược phẩm. Vậy bạn đã biết GMP là gì? Tiêu chuẩn GMP là gì chưa? Hãy cùng tìm hiểu với Thiết bị phòng sạch VCR các kiến thức bạn cần có về GMP ngay sau đây nhé!
GMP là gì
GMP là tiêu chuẩn thực hành sản xuất tốt nhằm đảm bảo điều kiện vệ sinh an toàn trong cấp phép sản xuất, buôn bán thực phẩm và đồ uống, mỹ phẩm, dược phẩm, thực phẩm chức năng, và thiết bị y tế.
GMP kiểm soát các yếu tố ảnh hưởng đến quá trình hình thành chất lượng sản phẩm từ khâu thiết kế, xây lắp nhà xưởng, dụng cụ chế biến, thiết bị; điều kiện phục vụ, chuẩn bị chế biến đến quá trình chế biến; bao gói, bảo quản và con người điều khiển các hoạt động trong suốt quá trình gia công, chế biến.

GMP là viết tắt của Good Manufacturing Practices, nó là một tiêu chuẩn không thể thiếu đối với các nhà máy sản xuất kể trên, đặc biệt là các nhà máy sản xuất Dược phẩm. Thực hiện GMP có thể giúp Doanh nghiệp giảm thất thoát và lãng phí, đồng thời bảo vệ cả công ty và người tiêu dùng khỏi các tiêu cực vấn đề an toàn.
Tại Việt Nam năm 2004, Bộ Y tế đã ban hành Quyết định số 3886/2004/QĐ-BYT Triển khai áp dụng nguyên tắc, tiêu chuẩn “Thực hành tốt sản xuất thuốc” đối với thuốc tân dược đến hết năm 2010 tất cả các doanh nghiệp sản xuất thuốc dùng ngoài và thuốc dược liệu phải đạt GMP-WHO. Điều này nói lên tầm quan trọng của GMP trong sản xuất, đặc biệt với sản xuất thuốc.
GMP còn là 1 tiêu chuẩn thực hành tốt quan trọng trong 5 tiêu chuẩn GPs trong ngành dược.
Các loại tiêu chuẩn GMP
Có rất nhiều loại GMP, ở một số nước sẽ có tiêu chuẩn về thực hành sản xuất tốt riêng. Tuy nhiên dưới đây là các loại tiêu chuẩn GMP phổ biến nhất mà bạn nên biết.
cGMP
cGMP (Current Good Manufacturing Practice) đề cập đến các quy định thực hành tốt sản xuất hiện tại thực thi bởi FDA (Food and Drug Administration - Cục quản lý thực phẩm và dược phẩm Hoa Kỳ).
Chữ "c" là viết tắt của " Current - hiện hành", giúp nhắc nhở các nhà sản xuất rằng họ phải sử dụng các công nghệ và hệ thống được cập nhật để tuân thủ quy định. Ngoài ra cGMP còn được gọi là FDA GMP.
Xem thêm: FDA là gì
Tiêu chuẩn GMP WHO
GMP WHO là gì
GMP WHO là tiêu chuẩn GMP được WHO (World Health Organization – Tổ chức Y tế thế giới) ban hành.
GMP-WHO được ban hành từ những năm 1960, được các nhà quản lý dược phẩm và ngành công nghiệp dược tại hàng trăm quốc gia trên thế giới, chủ yếu ở các nước đang phát triển áp dụng.
Tiêu chuẩn GMP WHO là gì
Tiêu chuẩn GMP WHO là một hệ thống tiêu chuẩn đảm bảo rằng các sản phẩm được sản xuất và kiểm soát một cách nhất quán theo các tiêu chuẩn chất lượng được Tổ chức Y Tế Thế Giới (WHO) đưa ra.
Tài liệu GMP WHO
Các bạn có thể tìm hiểu về WHO GMP theo bộ tài liệu Tại đây
Tiêu chuẩn GMP EU
GMP EU là gì
GMP EU là hướng dẫn thực hành tốt sản xuất thuốc, được ban hành bởi Cơ quan quản lý dược Châu Âu (EMA), nó mô tả các tiêu chuẩn tối thiểu mà cơ sở sản xuất thuốc phải đáp ứng trong quy trình sản xuất của mình.
Tiêu chuẩn GMP EU là gì
Tiêu chuẩn EU-GMP là toàn bộ hệ tiêu chuẩn được xây dựng và ban hành để kiểm soát các hoạt động trong cơ sở sản xuất dược phẩm nhằm đảm bảo các sản phẩm đầu ra bảo vệ sức khỏe, đạt chất lượng cao và đảm bảo an toàn cho người sử dụng. Hiện nay tiêu chuẩn GMP EU là một trong những tiêu chuẩn chất lượng cao nhất, rất khó và tốn kém để đạt chứng nhận.
Tài liệu về EU GMP
Bạn có thể tải bộ tài liệu hướng dẫn (Tiếng Anh) về GMP của cơ quan quản lý dược Châu Âu ở đây
Tiêu chuẩn Pic/s GMP
Pics GMP là gì
PICS là Công ước Thanh tra Dược phẩm và Chương trình Hợp tác Thanh tra Dược phẩm cung cấp các hướng dẫn GMP trong sản xuất Dược phẩm. Chủ yếu PIC/S cung cấp các hướng dẫn về hướng dẫn dược phẩm vô trùng.
Các quốc gia là thành viên của PIC/S sẽ có thể áp dụng tiêu chuẩn này. Hiện nay có 46 quốc gia là thành viên của PIC/S, chủ yếu thuộc Châu Âu và Châu Mỹ. Việt Nam cũng đang trong quá trình theo đuổi mục tiêu trở thành thành viên của tổ chức này.

Các nội dung chính của tiêu chuẩn GMP
Nội dung của tiêu chuẩn GMP bao gồm các tiêu chuẩn về mọi mặt trong nhà máy GMP, bao gồm: Tổ chức nhân sự, Cơ sở sản xuất, Máy móc thiết bị, Hồ sơ tài liệu, Sản xuất, Kiểm tra chất lượng, Khiếu nại và thu hồi sản phẩm và Tự thanh tra.
Tuy nhiên dựa trên các yêu cầu của GMP chúng ta có 5 yếu tố, nội dung lớn quan trọng và xuyên suốt như sau:
1. Nhân sự và Đào tạo GMP
Các cơ sở sản xuất phải tuân thủ nghiêm ngặt tiêu chuẩn GMP. Và để làm được điều đó, các công ty dược không thể không đào tạo GMP cho nhân viên. Và tất cả những người tham gia trong quá trình sản xuất thuốc phải có vai trò và trách nhiệm rõ ràng.
Điều quan trọng mà chúng ta cần nhớ là từ nghiên cứu và phát triển đến thị trường, tất cả nhân sự phải tuân thủ GMP.
2. Thủ tục
Cách thức mà tiêu chuẩn GMP quy trách nhiệm cho các nhà sản xuất là thông qua yêu cầu các thủ tục được lập thành văn bản và ghi chép trong quá trình sản xuất. Do đó, tất cả các thủ tục phải được trình bày rõ ràng và tuân theo quy chuẩn của GMP.
3. Sản phẩm và Nguyên vật liệu
- Các sản phẩm cuối cùng được bán cho người tiêu dùng và các nguyên liệu thô có liên quan đến quy trình sản xuất đều được kiểm soát bởi tiêu chuẩn.
- Thông số kỹ thuật của nguyên liệu và thành phần phải rõ ràng ở mọi giai đoạn sản xuất và phải có hồ sơ về công thức chính.
- Tuân thủ trong các quá trình đóng gói, thử nghiệm và lấy mẫu sản phẩm.
- Kết quả thử nghiệm phải được ghi lại để các nhà sản xuất chuẩn bị cho việc đánh giá GMP.
4. Mặt bằng và thiết bị
- Máy móc thiết bị phải được bố trí, thiết kế, kết cấu, điều chỉnh và bảo dưỡng phù hợp với các thao tác sẽ thực hiện. Việc bố trí và thiết kế của máy móc phải nhằm mục đích giảm tối đa nguy cơ sai sót và cho phép làm vệ sinh và bảo dưỡng có hiệu quả nhằm tránh nhiễm chéo, tích tụ bụi và bẩn, và nói chung là tránh những tác động bất lợi đối với chất lượng sản phẩm.
- Nhà xưởng cần có vị trí, được thiết kế, xây dựng, sửa chữa và bảo dưỡng phù hợp với các thao tác sản xuất sẽ diễn ra
Xem thêm: Các thiết bị phòng sạch
5. Quy trình
- Các quy trình phải được xác định rõ ràng, nhất quán và được đánh giá qua từng thời điểm.
- Nhà sản xuất phải có đề cương rõ ràng và các đánh giá viên phải cung cấp được sự tuân thủ cũng như sẵn sàng tự kiểm tra để tạo điều kiện thuận lợi cho mọi cải tiến có thể xảy ra.

Xem thêm: Tài liệu và Yêu cầu hồ sơ tiêu chuẩn GMP
10 Nguyên tắc cơ bản của GMP
Dưới đây là 10 nguyên tắc cơ bản của GMP mà chúng ta cần biết:
Nguyên tắc 1: Thiết kế nhà xưởng đúng ngay từ đầu
Việc thiết kế nhà xưởng đúng chuẩn ngay từ đầu là điều rất cần thiết đối với các doanh nghiệp sản xuất. Nếu nhà xưởng được thiết kế và xây dựng cơ sở vật chất và trang thiết bị đúng ngay từ đầu thì sẽ rất tốt trong việc đánh giá sự phù hợp cho Thực hành sản xuất tốt sau này.
Nguyên tắc 2: Quy trình thẩm định
Quy trình thẩm định là một nguyên tắc mà doanh nghiệp cần nắm rõ để giúp kiểm soát hoạt động của các thiết bị cũng như việc xây dựng nhà xưởng có đảm bảo tiêu chuẩn hay không. Đó là lý do tại sao quy trình thẩm định là nguyên tắc quan trọng
Nguyên tắc 3: Viết ra các quy trình và làm theo quy trình đã viết
Dù quy mô nhỏ hay lớn, doanh nghiệp nào cũng cần xây dựng các quy trình và làm theo quy trình đó. Đặc biệt, trong lĩnh vực dược phẩm, thực phẩm hay thiết bị y tế đều chú trọng đến quy trình tốt tại nơi làm việc.
Các doanh nghiệp có thể thuê người có chuyên môn và năng lực tốt để viết quy trình rõ ràng, logic, dễ hiểu, và dễ áp dụng cho mình. Ngoài ra, doanh nghiệp cũng cần có một bộ phận độc lập để rà soát nhằm cải tiến quy trình sao cho phù hợp nhất.
Nguyên tắc 4: Xác định ai làm cái gì?
Mọi nhân viên trong tổ chức cần được hiểu rõ nhiệm vụ của mỗi cá nhân là gì. Công việc được giao cho họ bao gồm những gì.
Nguyên tắc 5: Ghi chép hồ sơ tốt
Ghi chép hồ sơ tốt là một trong 10 nguyên tắc cơ bản của GMP mà chúng ta cần ghi nhớ. Ghi chép hồ sơ sẽ giúp cho doanh nghiệp theo dõi được tất cả các hoạt động được thực hiện trong quá trình sản xuất.

Nguyên tắc 6: Đào tạo và phát triển nhân viên
Để vận hành tốt nhất, doanh nghiệp nên xây dựng một chương trình đào tạo cụ thể cho mọi nhân viên trong khu sản xuất hoặc kiểm nghiệm cũng như các hoạt động liên quan đến chất lượng sản phẩm. Và chúng ta đều biết rằng, nhân sự là yếu tố quan trọng trong bất kỳ tổ chức nào.
Nguyên tắc 7: Thực hành vệ sinh tốt
Doanh nghiệp cần có chương trình vệ sinh môi trường để giảm thiểu nguy cơ sản phẩm bị nhiễm ở mức tối thiểu. Ngoài ra, công ty cũng nên phát triển một chương trình có thể đáp ứng các yêu cầu về độ sạch cần thiết cho sản phẩm.
Yêu cầu với từng cá nhân nhân viên luôn giữ gìn vệ sinh sạch sẽ như rửa tay sau khi đi vệ sinh để chống nhiễm bẩn.
Nguyên tắc 8: Bảo dưỡng nhà xưởng và thiết bị
Bảo dưỡng nhà xưởng và thiết bị là một trong 10 nguyên tắc cơ bản của GMP mà doanh nghiệp cần phải lưu ý. Để ngăn ngừa các nguy cơ thiết bị bị hỏng đột xuất làm ảnh hưởng đến quá trình sản xuất thì cần bảo trì các thiết bị thường xuyên.
Bảo dưỡng các thiết bị cũng là cách giúp làm giảm nguy cơ ô nhiễm sản phẩm và duy trì các “trạng thái đã thẩm định” của cơ sở hoặc thiết bị. Đôi khi một sự cố bất ngờ có thể ảnh hưởng đến các nhà xưởng, thiết bị và trong những hoàn cảnh như vậy, doanh nghiệp cần phải tiến hành sửa chữa ngay lập tức.
Nguyên tắc 9: Thiết kế chất lượng dựa vào toàn bộ vòng đời sản phẩm
Xây dựng chất lượng vòng đời sản phẩm là yếu tố vô cùng quan trọng vì sức khỏe cũng như sự an toàn của khách hàng phụ thuộc rất lớn vào chất lượng sản phẩm.
Nguyên tắc 10: Thanh tra thường xuyên
Doanh nghiệp, tổ chức cũng nên tự thanh tra vài lần trong một năm để đảm bảo các quy trình sản xuất tuân thủ theo đúng GMP. Ngoài ra, doanh nghiệp cũng có thể tiến hành thanh tra bằng cách tập trung vào những khu vực khác nhau của khu vực sản xuất hoặc các bộ phận khác nhau để kiểm soát hiệu quả hơn.
Ngoài ra có các cơ quan thanh tra bên ngoài như Cục Quản lý Thực phẩm và Dược phẩm (FDA – Mỹ) hoặc (TGA – Úc) sẽ tiến hành các kiểm tra.
Chứng chỉ, chứng nhận và quy trình đạt chứng nhận GMP
Chứng nhận GMP là gì?
Chứng nhận GMP là chứng nhận đạt được khi các cơ sở sản xuất, doanh nghiệp xây dựng và sở hữu nhà máy đạt tiêu chuẩn GMP theo quy định đề ra được các cơ quan thẩm quyền tương ứng như Cục quản lý dược, EMA cấp.
Có những loại giấy chứng nhận GMP nào?
- Giấy chứng nhận WHO-GMP.

- Giấy chứng nhận EU GMP
- Giấy chứng nhận Pics GMP
- Chứng nhận GMP HS
- Chứng nhận ASEAN GMP
Đơn vị cấp giấy chứng nhận GMP
Mỗi loại chứng nhận sẽ được cấp bởi một cơ quan có thẩm quyền khác nhau:
- Giấy chứng nhận WHO-GMP: Được cấp bởi Cục quản lý dược
- Giấy chứng nhận EU-GMP : Được cấp bởi cơ quan quản lý dược các nước hoặc cơ quan quản lý dược cấp bang của các nước thành viên EU.
- Giấy chứng nhận PIC/S-GMP: Được cấp bởi cơ quan có thẩm quyền về quản lý dược là thành viên của PIC/S.
Hồ sơ xin đánh giá cấp và đánh giá tái cấp giấy chứng nhận GMP

Dưới đây là các hồ sơ để được cấp chứng nhận GMP cho nhà sản xuất dược phẩm:
1. Đơn đăng ký kiểm tra “Thực hành tốt sản xuất thuốc”.
2. Bản sao có chữ ký và đóng dấu xác nhận của cơ sở: Giấy phép thành lập cơ sở hoặc Giấy đăng ký kinh doanh hoặc Giấy chứng nhận đầu tư
3. Sơ đồ tổ chức, nhân sự của cơ sở.
4. Tài liệu, chương trình và báo cáo tóm tắt về huấn luyện, đào tạo “Thực hành tốt sản xuất thuốc” tại cơ sở.
5. Sơ đồ vị trí địa lý và thiết kế của nhà máy, bao gồm:
- Sơ đồ mặt bằng tổng thể
- Sơ đồ đường đi của công nhân
- Sơ đồ đường đi của nguyên liệu, bao bì, bán thành phẩm, thành phẩm
- Sơ đồ hệ thống cung cấp nước phục vụ sản xuất
- Sơ đồ cung cấp khí cho nhà máy
- Sơ đồ thể hiện các cấp độ sạch của nhà máy
- Sơ đồ xử lý chất thải
Xem thêm: GMP bao bì dược phẩm
6. Danh mục thiết bị hiện có của nhà máy.
Quy trình cấp chứng nhận GMP
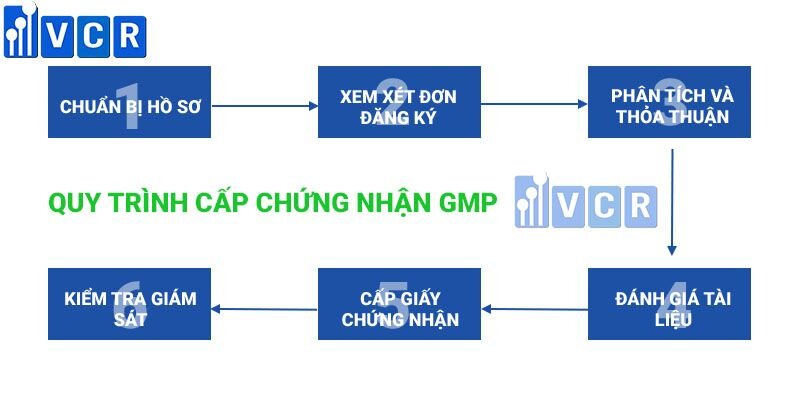
1. Chuẩn Bị Hồ Sơ
Đây là bước đầu tiên để được chứng nhận GMP; hồ sơ này bao gồm một số dữ liệu thiết yếu của tổ chức. Cơ quan xác nhận phải xác nhận việc áp dụng và cần thiết phải ghi lại hoặc lưu giữ tất cả các dữ liệu trên cơ sở dữ liệu GMP.
2. Xem Xét Đơn Đăng Ký
Ứng dụng sẽ được nhóm khảo sát để đảm bảo rằng sự cần thiết về tính nhất quán đã được đáp ứng.
3. Phân Tích & Thỏa Thuận
Sau khi kiểm tra các tài liệu, hãy đưa ra trích dẫn giá trị để thực hiện Phân tích khoảng cách để bao gồm tất cả các điều kiện và phạm vi của các nguyên tắc chất lượng. Phân tích Khoảng cách được thực hiện để kiểm tra Khoảng cách giữa những việc được tổ chức sắp xếp và những việc đã hoàn thành.
4. Đánh Giá Tài Liệu
Kiểm tra tài liệu của tổ chức để đảm bảo rằng tài liệu đó được đáp ứng với điều kiện tiên quyết về tuân thủ.
5. Cấp Giấy Chứng Nhận
Tổ chức Chứng nhận sẽ cấp một chứng chỉ về sự tuân thủ, chứng chỉ này có ý nghĩa quan trọng trong một thời gian dài.
6. Kiểm Tra Giám Sát
Việc xem xét giám sát dẫn đến đảm bảo rằng hiệp hội đáp ứng các điều kiện tiên quyết của khuôn khổ quản lý. Đánh giá quan sát phải được thực hiện trong sáu tháng hoặc một năm một lần kể từ ngày được cấp chứng chỉ.
Các tiêu chuẩn GMP trong sản xuất dược phẩm
Theo quyết định của Bộ Trưởng Bộ Y tế: Đến hết năm 2010, tất cả các doanh nghiệp có chức năng sản xuất thuốc dược liệu phải đạt tiêu chuẩn GMP-WHO.
Do đó các doanh nghiệp phải đạt được các tiêu chuẩn GMP trong sản xuất dược phẩm như sau:
Yêu cầu về nhân sự:
Với nhân sự, yêu cầu đặt ra là cần có chuẩn mực các vị trí làm việc để tuyển dụng phù hợp về trình độ, năng lực. Không chỉ vậy cần xây dựng quy định về kiểm tra sức khỏe (thể lực, trí lực và bệnh tật) của tất cả mọi người quan trọng nhất là những công nhân sản xuất trực tiếp.
Yêu cầu về thiết kế, xây dựng, lắp đặt nhà, xưởng và thiết bị chế biến:
Với ngành dược phẩm điều này vô cùng quan trọng. Doanh nghiệp phải có quy định về vị trí đặt nhà máy, thiết kế, loại nguyên vật liệu để xây dựng nhà xưởng, thiết bị phù hợp để tạo ra những sản phẩm chất lượng.

Yêu cầu kiểm soát vệ sinh nhà xưởng, môi trường:
Các doanh nghiệp này cần xây dựng các quy định về xử lý nước dùng để sản xuất, xử lý nước thải, xử lý sản phẩm phụ và rác thải, vệ sinh môi trường và nhà xưởng… Đây là tiền đề để sản xuất ra những sản phẩm đảm bảo vệ sinh.
Yêu cầu về kiểm soát quá trình chế biến:
Doanh nghiệp cần xây dựng các quy định về phương pháp chế biến, thủ tục, hướng dẫn công việc cụ thể và các tiêu chuẩn về nguyên liệu, sản phẩm, công thức pha chế. Bên cạnh đó cần có các biện pháp kiểm tra, giám sát quá trình sản xuất.
Yêu cầu về kiểm soát quá trình bảo quản và phân phối sản phẩm:
Sản xuất đảm bảo thôi là chưa đủ. Doanh nghiệp cần đưa ra các yêu cầu về việc vận chuyển và bảo quản sao cho thành phẩm phải đảm bảo không bị nhiễm bẩn bởi các tác nhân vật lý, hoá học, vi sinh, không thay đổi chất lượng…
Những ngành cần áp dụng tiêu chuẩn GMP
Thực phẩm
Thực phẩm là một ngành quan trọng, ảnh hưởng rất nhiều tới người tiêu dùng. Vì vậy việc áp dụng tiêu chuẩn GMP trong thực phẩm là rất quan trọng.
Xem thêm: Xây dựng nhà máy sản xuất sữa theo tiêu chuẩn GMP
Dược phẩm
GMP là tiêu chuẩn dường như được tạo ra để sử dụng cho các nhà máy sản xuất Dược phẩm, thậm chí người ta còn gọi nó là thực hành tốt sản xuất thuốc. Các sản phẩm thuốc ảnh hưởng trực tiếp đến an toàn sử dụng đối với người tiêu dùng. Do đó áp dụng tiêu chuẩn GMP trong sản xuất thuốc là không thể thiếu cho mọi doanh nghiệp dược phẩm.
Mỹ phẩm
Các sản phẩm mỹ phẩm ngày càng được người tiêu dùng Việt Nam quan tâm và sử dụng nhiều. Để kiểm soát chất lượng cho các sản phẩm này thì việc áp dụng GMP trong sản xuất mỹ phẩm là cần thiết.
Thiết bị y tế
Các thiết bị Y tế đòi hỏi rất nhiều quy trình quan trọng và cần có được độ chính xác cao.
Lợi ích của tiêu chuẩn GMP
Các nhà sản xuất dược phẩm và thiết bị y tế đều tuân theo các quy tắc và quy trình GMP trong khi một số nhà sản xuất đã tạo ra các hướng dẫn riêng phù hợp với luật pháp của họ.
Lợi ích đối với Nhà sản xuất
- Xác định kịp thời các nhà sản xuất và các vấn đề quản lý,
- Tuân thủ luật và hướng dẫn quan trọng,
- Nâng cao uy tín thương hiệu,
- Giảm rủi ro an toàn về chất lượng và độ an toàn của sản phẩm,
- Tăng niềm tin của người tiêu dùng vào sản phẩm.
- Giúp giảm chi phí vận hành do làm lại và phạt do không tuân thủ,
- Giúp thúc đẩy cơ hội xuất khẩu,
- Giảm việc kiểm tra trùng lặp,
- Tiết kiệm chi phí.
Một trong những lợi ích chính là hệ thống chất lượng được cải thiện đáng kể và việc tuân thủ chất lượng tại nhà sản xuất. Chúng tôi đã thấy những cải tiến này trong những tháng dẫn đến chứng nhận GMP và tiếp tục trong những năm ngay sau chứng nhận GMP.
Lợi ích đối với Người tiêu dùng
Khách hàng thường sẽ giảm bớt sự e dè của họ đối với các nhà sản xuất đã đạt được chứng nhận GMP. Người tiêu dùng biết rằng để được chứng nhận, nhà sản xuất phải có sẵn các hệ thống và cung cấp bằng chứng rằng sự không phù hợp và những thay đổi cần thông báo của khách hàng được xử lý một cách thích hợp.

Sự đảm bảo này thường không đạt được thông qua cuộc kiểm tra nhà cung cấp kéo dài một ngày mà các công ty dược phẩm thực hiện; thay vào đó, nó có được là kết quả của các cuộc đánh giá kỹ lưỡng, nhiều ngày đối với nhà sản xuất như một phần của chương trình đánh giá chứng nhận.
Vậy là chúng ta đã giải quyết được câu hỏi GMP là gì? Tiêu chuẩn GMP là gì và nhiều kiến thức quan trọng khác về GMP. Mong rằng bài viết sẽ giúp bạn hiểu hơn về tiêu chuẩn GMP từ đó bạn có thể áp dụng cho doanh nghiệp của mình.
Thực hành tốt (Good Practice) là tiêu chuẩn quan trọng để đảm bảo tính chất lượng, độ an toàn và hiệu quả của các sản phẩm y tế và dược phẩm. Có năm tiêu chuẩn thực hành tốt được áp dụng trong ngành y tế, bao gồm GLP, GMP, GSP, GPP và GDP. Các tiêu chuẩn này giúp tăng cường sự tin tưởng của khách hàng và cộng đồng, cũng như giúp các doanh nghiệp nâng cao năng lực cạnh tranh trên thị trường.



![[Cập nhật 2024] Tiêu chuẩn ISO 14644 - TCVN 8664 – Tiêu chuẩn dành cho phòng sạch](/vcr-media/crop/347_347/22/8/11/tieu-chuan-quoc-gia-ve-phong-sach.jpg)

















